Syndrome d'hypoplasie du ventricule gauche
Définition et épidémiologie
L’hypoplasie du ventricule gauche est une entité extrêmement rare (0,016 à 0, 036% de toutes les naissances vivantes [1] et 1% des cardiopathies congénitales[2]) mais au pronostic extrêmement sombre.
Ce terme regroupe différentes anomalies aboutissant à un ventricule gauche hypoplasique, incapable d’assurer le débit systémique.
Embryologie
L’origine embryologique n’est pas connue à ce jour, et différents facteurs semblent être impliqués. Toute anomalie diminuant le débit sanguin de la voie gauche peut aboutir à une hypoplasie du VG : atrésie aortique, atrésie mitrale…
Description anatomique et Variantes
Dans tous les cas, le ventricule gauche est hypoplasique et l’aorte ascendante apparaît filiforme en aval d’un orifice aortique atrétique la majorité du temps.les artères coronaires sont de morphologie et d’origine aortique normales. La valve mitrale est également sous développée.
Néanmoins des formes plus ou moins sévères sont décrites :
- Formes majeures, les plus fréquentes, où le ventricule gauche est virtuel, associé à une atrésie aortique et mitrale avec une CIA et des artères coronaires normales.
- Formes modérées, avec un VG très hypoplasique, une atrésie aortique avec mitrale perméable, et développement de fistules coronaro-camérales.
- Formes mineures, à la limite du cadre nosologique du syndrome.
Il s’y associe de manière quasi-systématiques : une communication interauriculaire restrictive ou non, des cavités droites dilatées et une oreillette gauche hypertrophique [2].
Physiopathologie
C’est l’exemple même de la pathologie ducto-dépendante: la vascularisation systémique n’est assurée que par le canal artériel, qui vascularise l’aorte ascendante, les tronc supra-aortiques et les coronaires a retro, et l’aorte descendante. D’où l’évolution clinique dramatique à sa fermeture.[3]
Clinique
A la naissance, les nouveau-nés vont bien, c’est dans les heures suivant la naissance, lors de la fermeture du canal artériel, qu’apparaît un état de choc cardiogénique avec marbrures, hypoxie, cyanose.
Sans intervention, l’évolution se fait vers le décès dans les mois qui suivent.
Traitement
Avant les années 80, aucun traitement actif n’était entrepris, seul le traitement palliatif l’était.
Dans les années 80, Norwood a développé une technique chirurgicale qui a pour but d’aboutir à une circulation univentriculaire où le ventricule droit devient le ventricule systémique. Ce résultat nécessite trois interventions chirurgicales.
La première étape ou intervention de Norwood modifié par Sano :
Réalisée dans la période néonatale, elle consiste à sectionner le tronc de l’artère pulmonaire, réaliser une plastie d’agrandissement de l’aorte, une septotomie atriale et mise en place d’un conduit VD- AP non valvé.
Initialement, le flux sanguin pulmonaire était assuré par un shunt type Blalock-Taussig modifié, mais Sano a modifié la technique avec un tube VD-AP, d’où le terme d’intervention de Norwood avec modification de Sano.
La deuxième étape : intervention de Glenn
Réalisée à 4-6 mois de vie, elle consiste à une intervention de type dérivation cavopulmonaire bidirectionnelle: la veine cave supérieure est anastomosée à l’artère pulmonaire droite pour assurer le flux sanguin pulmonaire, et le conduit VD-AP ou le shunt de type Blalock est ligaturé.
La dernière étape : intervention de Fontan
Réalisée vers 2-3 ans, elle consiste en une totalisation de la dérivation cavopulmonaire par redirection du flux sanguin de la veine cave inferieure vers l’artere pulmonaire par un conduit intra-atrial ou extra-cardiaque.
Certaines équipes réalisent des transplantations cardiaques, mais cela reste anecdotique étant donné le peu de donneur et le risque lié à l’immunosuppression ainsi que le développement d’une pathologie coronarienne précoce. Il est à noter que dans un nombre encore non négligeable de centre, seul un accompagnement est réalisé[4].
Evolution
Avec l’avènement de l’intervention de Norwood, le pronostic s’est nettement modifié. Néanmoins, cette cardiopathie reste un challenge pour les équipes médico-chirurgicales.
Chaque étape chirurgicale est à risque et tous les enfants ne seront pas candidats pour une intervention de Fontan, en raison de résistances vasculaires pulmonaires trop importantes. En effet, avant une intervention de Fontan, un cahier des charges strict doit être rempli, sinon l’intervention est contre-indiquée.
Au total, environ 70% des patients atteindront l’âge adulte de nos jours.[5]
La mortalité post-opératoire de la première intervention est de 30% de nos jours [6].
La mortalité post-opératoire après l’intervention de Glenn et de Fontan est très faible [1].
La qualité de vie semble correcte, néanmoins ces enfants ont souvent des problèmes de développement psychomoteur à ne pas sous-estimer.
Les complications cardiaques à long terme sont dominées par l’insuffisance cardiaque et les arrythmies auriculaires, auxquelles s’ajoutent les problèmes liés à l’hémodynamique de l’intervention de Fontan : entéropathie exsudative, cirrhose, épanchement pleural et péricardique, thrombose, collatérales aorto-pulmonaires et fistules artério-veineuses [5].
Imagerie
Préopératoire
L’échocardiographie est largement suffisante .
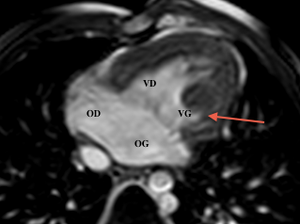
Postopératoire

En pré-opératoire d’une intervention de Glenn puis de Fontan:
Un cathétérisme cardiaque est indiqué dans la majorité des cas, devant la nécessité de connaître les résistances vasculaires pulmonaires.
Certaines études montrent l’intérêt que peut avoir l’IRM ou le scanner, avant intervention de Glenn.
En effet, il est alors primordial de connaître clairement l’anatomie des artères pulmonaires, et de l’arche aortique, la présence de sténoses éventuelles et la morphologie du conduit VD-AP ; ainsi que la fonction ventriculaire droite, qui a la fonction de ventricule systémique[7,8,9]
L’IRM est préférée au scanner, permettant une analyse des anastomoses réalisées, de leur aspect et leur perméabilité, ainsi que l’évaluation de la fonction du ventricule systémique.
Il faut également rechercher des complications :
- Thromboses intraauriculaire, du conduit VCS- AP, embolie pulmonaire
- Dilatation de l’oreillette droite ou du conduit entre la VCS et les artères pulmonaires.
- Malformations artérioveineuses pulmonaires entre veines bronchiques et pulmonaires voire entre oreillette gauche et veines bronchiques
- Collarérales aorto-pulmonaires
- Dilatation de la VCI et des veines sus-hépatiques avec développement possible d’une cirrhose hépatique, l’aspect du foie est donc important à décrire
- La présence d’anomalies bronchiques, pouvant être à l’origine d’atéléctasie( plastic bronchitis des anglophones ou moules bronchiques).
- La présence ou non d’insufisance valvulaire mitrale
- Epanchement pleural, péricardique ou chylothorax[10].

Bibliographie
- Connor JA, Thiagarajan R. Hypoplastic left heart syndrome. Orphanet Journal of Rare Diseases. 2007 ; 2 : 23
- Kachaner J. Hypoplasie du cœur gauche. EMC Cardiologie. [11-041-C-10]
- Bardo DM, Frankel DG, Applegate KE, Murphy DJ, Saneto RP. Hypoplastic left heart syndrome. Radiographics. 2001 ; 21 : 705-717
- Karamlou T, Diggs BS, Ungerleider RM, Welke KF.Evolution of treatment options and outcomes for hypoplastic left heart syndrome over an 18-year period. J Thorac Cardiovasc Surg 2010; 139:119-27
- Feinstein JA, Benson DW, Dubin AM, Cohen MS, Maxey DM, Mahle WT, Pahl E, Villafañe J, Bhatt AB, Peng LF, Johnson BA, Marsden AL, Daniels CJ, Rudd NA, Caldarone CA, Mussatto KA, Morales DL, Ivy DD, Gaynor JW, Tweddell JS, Deal BJ, Furck AK, Rosenthal GL, Ohye RG, Ghanayem NS, Cheatham JP, Tworetzky W, Martin GR. Hypoplastic left heart syndrome : current considerations and expectations. JACC. 2012 ; 59 :S1-S42
- Breymann T, Kirchner G, Blanz U, Cherlet E, Knobl H, Meyer H, Körfer R, Thies WR. Results after Norwood procedure and subsequent cavopulmonary anastomoses for typical hypoplastic left heart syndrome and similar complex cardiovascular malformations. Eur J Cardiothorac Surg.
- Kondo C, Hardy C, Higgins SS, Young JN, Higgins CB. Nuclear Magnetic Resonance Imaging of the Palliative Operation for Hypoplastic Left Heart Syndrome J Am Coll Cardiol 1991;78:817-23)
- Muthurangu V, Taylor AM, Hegde SR, Johnson R, Tulloh R, Simpson JM, Qureshi S, Rosenthal E, Baker E, Anderson D, Razavi R. Cardiac magnetic resonance imaging after stege 1 Norwood operation fro hypoplastic left heart syndrome. Circulation. 2005;112:3256-3263.
- Lim DS, Peeler BB, Matherne GP, Kramer CM. Cardiovascular magnetic resonance of pulmonary artery growth and ventricular function after Norwood procedure with sano modification. Journal of cardiovascular magnetic resonance.2008 ; 10 :34
- Fredenburg TB, Johnson TR, Cohen MD. The Fontan Procedure: Anatomy, Complications, and Manifestations of Failure. RadioGraphics 2011; 31:453–463